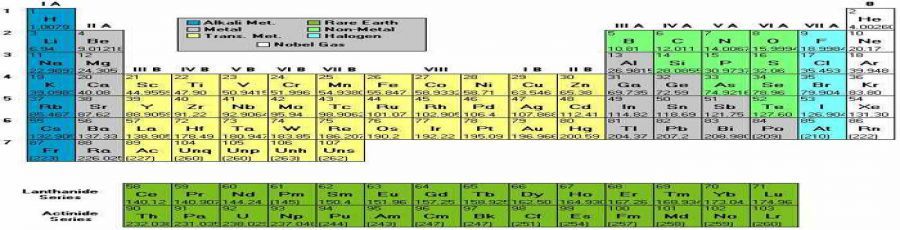
Az elemek olyan anyagok amelyek:
-Kémiailag tiszta
-Kémiai rakcióval tovább nem bontható
-Kémiailag azonos atomokat tartalmazó
-Egyszerű anyag
Az elemek mind megtalálhatók a periódusos rendszerben.
Azok az anyagok amelyek proton- és elektronszámuk megegyezik valamely elemmel, de neutronszámuk különbözik azokat izotópoknak nevezzük. Pl:elem: H Hidrogén (0 neutron)
izotópjai: D Deutérium (1 neutron)
T Trícium (2 neutron)
A Hidrogén izotópjai mind stabilak.
Hidrogén
|
|
||||||||||||||||||||||
|
Általános |
||||||||||||||||||||||
|
Név, vegyjel, rendszám |
hidrogén, H, 1 |
|||||||||||||||||||||
|
Elemi sorozat |
nemfémek |
|||||||||||||||||||||
|
Csoport, periódus, mező |
1, 1, s |
|||||||||||||||||||||
|
Megjelenés |
színtelen |
|||||||||||||||||||||
|
Atomtömeg |
1,00794 g/mol |
|||||||||||||||||||||
|
Elektronszerkezet |
1s1 |
|||||||||||||||||||||
|
Elektronok héjanként |
1 |
|||||||||||||||||||||
|
Fizikai tulajdonságok |
||||||||||||||||||||||
|
Halmazállapot |
gáz |
|||||||||||||||||||||
|
Sűrűség (szobahőm.) |
0,0899 g/cm³ |
|||||||||||||||||||||
|
Sűrűség (folyadék) az o.p.-on |
- g/cm³ |
|||||||||||||||||||||
|
Olvadáspont |
14,025 K |
|||||||||||||||||||||
|
Forráspont |
20,268 K |
|||||||||||||||||||||
|
Olvadáshő |
0,05868 kJ/mol |
|||||||||||||||||||||
|
Párolgáshő |
0,44936 kJ/mol |
|||||||||||||||||||||
|
Moláris hőkapacitás |
(25 °C) 28,836 J/(mol·K) |
|||||||||||||||||||||
|
||||||||||||||||||||||
|
Atomi tulajdonságok |
||||||||||||||||||||||
|
Kristályszerkezet |
hexagonális |
|||||||||||||||||||||
|
Oxidációs állapotok |
1, -1 |
|||||||||||||||||||||
|
Elektronegativitás |
2,20 (Pauling-skála) |
|||||||||||||||||||||
|
Ionizációs energia |
1.: 1312 kJ/mol |
|||||||||||||||||||||
|
Atomsugár |
25 pm |
|||||||||||||||||||||
|
Atomsugár (számított) |
53 pm |
|||||||||||||||||||||
|
Kovalens sugár |
37 pm |
|||||||||||||||||||||
|
Van der Waals-sugár |
120 pm |
|||||||||||||||||||||
|
Egyebek |
||||||||||||||||||||||
|
Hővezetési tényező |
(300 K) 180,5 W/(m·K) |
|||||||||||||||||||||
|
Hangsebesség |
(gáz, 27 °C) 1310 m/s |
|||||||||||||||||||||
|
CAS-szám |
1333-74-0 |
|||||||||||||||||||||
|
|
||||||||||||||||||||||
|
|
||||||||||||||||||||||
|
|
||||||||||||||||||||||
A hidrogén periódusos rendszer első kémiai eleme. A hidrogénatom vegyjele H, rendszáma 1. A hidrogén valójában igen ritkán fordul elő önálló atomként, legtöbbször kétatomos molekulákat alkot, melyek képlete H2. Normálállapotban színtelen, szagtalan, íztelen, nemfémes, egy vegyértékű, igen gyúlékony gáz. Nagyon jó hővezető. Vízben igen kis mértékben oldódik, nagyon jól oldódik egyes fémekben (palládium, platina, nikkel). A hidrogén a legkönnyebb és egyben a világegyetemben leggyakrabban előforduló elem. A Földön leginkább vegyületeivel találkozhatunk: jelen van a vízben, szinte minden szerves vegyületben és minden élőlényben. A fősorozatbeli csillagok nagyrészt plazma halmazállapotú hidrogénből állnak, amit apránként héliummá égetnek el. A többi kozmikus testre általánosan igaz, hogy minél nagyobb, annál több benne a hidrogén: a kisebb égitestek gravitációs mezeje nem képes az igen kis sűrűségű hidrogéngázt légkörében huzamosan megtartani.
Laboratóriumi előállítása során erős savakat reagáltatnak valamilyen negatív standardpotenciálú fémmel, például cinkkel. Ipari mennyiségű hidrogént többnyire földgáz és vízgőz reakciójával állítanak elő. A víz elektrolízise a hidrogén előállításának egyszerű, de energia, így költségigényes módja.
Története
A hidrogént először Robert Boyle állította elő 1671-ben. Henry Cavendish fedezte fel 1766-ban, hogy önálló elem. „Vízképzőt” jelentő nevét a görög hudôr=víz és a gennen=képezni szavak összevonásával Antoine Lavoisier adta. A deutériumot 1931-ben Harold Urey amerikai kémikus fedezte fel. 1839-ben sir William Robert Grove brit tudósnak sikerült a vizet elektromos árammal hidrogénre és oxigénre bontania.
A kétatomos hidrogénmolekula modellje
Fizikai tulajdonságai
A hidrogén a legegyszerűbb atomszerkezetű kémiai elem, leggyakoribb izotópja, a prócium csak egy protonból és egy elektronból áll.
Normálállapotban kétatomos gáz, képlete H2. A normálállapotú levegőnél sűrűsége 14,5-ször kisebb.
Mivel a hidrogénmolekuláknak nincsenek polarizálható elektronjaik, ezért a közöttük kialakuló diszperziós kölcsönhatás erőssége, így a kohézió is rendkívül kicsi. Ezért a hidrogénnek igen alacsony, mindössze 20,27 K a forráspontja, olvadáspontja pedig 14,02 K. Igen nagy nyomáson, például gázóriások belsejében, a hidrogén molekulái elveszítik önállóságukat, és folyékony fémmé állnak össze (fémes hidrogén). Az űrben található igen alacsony nyomáson általában atomos formában létezik – egyszerűen azért, mert a hidrogénatomok nem találkoznak egymással; a csillagok keletkezésekor az első lépés a H2-felhők kialakulása.
Fontos szerepe van az univerzum energiaellátásában a proton-proton reakción és a szén-nitrogén cikluson keresztül.
Kémiai tulajdonságai
A hidrogén gyúlékony anyag, vízzé ég el.
2H2+ O2 → 2H2O
A hidrogéngáz és az oxigéngáz keveréke durranógázt alkot. Ha meggyújtjuk, csattanó hanggal felrobban. (TILOS oxigént és hidrogént tartalmazó tartályok egymás melletti tárolása a robbanásveszély miatt!) A tiszta hidrogén csendesen ég.
A hidrogén jó redukálószer. A réz-oxidtól elvonja az oxigént.
CuO + H2 → Cu + H2O
Ugyanakkor a legkisebb elektronegativitású fémekkel ionkötésű hidrideket képez, tehát ekkor oxidálószer:
Ca + H2 → CaH2
Előállítása
- Laboratóriumi előállítás: cinkre sósavat öntünk. Ekkor cink-klorid és hidrogén keletkezik.
Zn + 2HCl = ZnCl2 + H2
- Előállítható alkálifém és víz reakciójával is:
2Na + 2H2O = 2NaOH + H2
A fenti reakció nagyon heves, ezért lehetőleg lelassítják (például az alkálifémet amalgám formájában használjak, vagy víz helyett kevésbé aktív etil-alkoholt használnak).
- A hidrogén a víz elektromos bontásával is előállítható (elektrolízissel). A hidrogén a katódon válik ki.
2H2O = O2 + 2H2
- Ipari előállítás: metán és vízgőz reakciója. Ekkor szén-monoxid és hidrogén keletkezik.
CH4 + H2O = CO + 3H2
- Másik lehetséges előállítási mód, hogy izzó vascsövön vízgőzt vezetnek át:
3Fe + 4H2O = Fe3O4 + 4H2
Felhasználása
Az iparnak nagy mennyiségű hidrogénre van szüksége az ammónia előállításához (Haber-féle ammóniaszintézis), zsírok és olajok hidrogénezéséhez, és metil-alkohol (metanol) gyártásához. Egyéb felhasználási területei:
- sósavgyártás, hegesztés, fémek redukciója
- rakétaüzemanyag
- folyékony hidrogént használnak kriogenikai kutatásokban, például a szuperfolyékonyság vizsgálatában
- Mivel 14 és félszer könnyebb a levegőnél, valamikor léghajók töltőgázaként is használták – gyúlékonysága miatt azonban ezzel felhagytak.
- A deutériumot, a hidrogén egyik izotópját (2H) maghasadás során moderátorként alkalmazzák, fúziós kísérletekben szintén használják.
- A tríciumot (3H) nukleáris reaktorokban állítják elő, hidrogénbomba gyártásához használható. Ezentúl biológiai kutatásokban jelölő izotóp lehet, illetve fényes festékekben a világító komponens.
Elégethető belső égésű motorokban is, a Chrysler-BMW-nek vannak ilyen járművei. Újabban alternatív üzemanyagként az üzemanyagcellákban használják.
Vegyületei
A hidrogén a legtöbb kémiai elemmel képes vegyülni. Elektronegativitása 2,2-es, a nemfémek közül a legkisebb. Mivel csak egy elektronja van és elektronhéja két elektronnal telítődik (1s2), a hidrogénatom egy elektron felvételével vagy leadásával is ionná alakulhat. Ha elektront vesz fel, negatív töltésű hidridionná (H−) alakul. Kis ionizációs energiájú elemekkel (alkálifémekkel, alkáliföldfémekkel) olyan ionvegyületekké egyesülhet, amelyeknek a kristályrácsa pozitív töltésű fémionokból és negatív töltésű hidridionokból áll. Ezeket a vegyületeket sószerű hidrideknek nevezzük. Ha elektront ad le, általában kovalens kötést alkot, mivel önmagában a H+-ion egy csupasz proton lenne és könnyen elektronokat vonzana magához.
Robbanásszerű égése miatt a hidrogén és az oxigén keverékét durranógáznak hívják. A reakció terméke a víz (H2O). A deutérium-oxidot (D2O) nehézvíznek nevezik. A szénnel rengeteg, különféle szerkezetű vegyületet alkot; ezek a szénhidrogének. Mivel az élőlények zömmel a szén és a hidrogén (oxigénnel, nitrogénnel, foszforral stb. közös) vegyületeiből állnak, ezeket szerves vegyületeknek nevezik, a velük foglalkozó tudományágat pedig szerves kémiának.
A hidrogén biner vegyületei (hidridek)
kovalens hidridek (jellemzően a p-mező elemeivel):
|
IV. A |
V. A |
VI. A |
VII. A |
|
CH4 |
NH3 |
H2O |
(HF)x |
|
SiH4 |
PH3 |
H2S |
HCl |
|
GeH4 |
AsH3 |
H2Se |
HBr |
|
SnH4 |
SbH3 |
H2Te |
HI |
polimer hidridek:
bórral (boránok): BxHy, ahol x maximum ~25
szénnel (szénhidrogének): CxHy, ahol x-nek elvileg nincs felső határa
szilíciummal (szilánok): SixHy, ahol x maximum ~8
germániummal (germánok): GexHy, ahol x maximum ~5
ionrácsos (sószerű) hidridek (jellemzően az alkáli- és alkáliföldfémekkel):
|
I. A |
II. A |
|
LiH |
BeH2 |
|
NaH |
MgH2 |
|
KH |
CaH2 |
|
RbH |
SrH2 |
|
CsH |
BaH2 |
fémes (intersticiális) hidridek (jellemzően a d-mező és f-mező elemeivel):
|
III. B |
IV. B |
V. B |
VI. B |
VII. B |
VIII. B |
I. B |
II. B |
|
ScH2 |
TiH2 |
VH |
CrH |
x |
x |
CuH |
ZnH |
|
YH2 |
ZrH2 |
NbH |
x |
x |
PdHx (x<1) |
x |
x |
|
LaH2 |
HfH2 |
TaH |
x |
x |
x |
x |
x |
komplex hidridek: [BH4]-, [AlH4]-
Típusai kvantumfizikai szempontból
Kvantumfizikai szempontból kétféle hidrogén-molekula (H2) különböztethető meg (magspin-izomerek):
ortohidrogén:
a két proton spinje azonos irányú (paralel)
az eredő magspinmomentum: S=1 → Bose-Einstein-statisztika
0 K-en 0%-os az előfordulása
300 K-en 75%-os az előfordulása
parahidrogén:
a két proton spinje ellentétes irányú (antiparalel)
az eredő magspinmomentum: S=0 → Bose-Einstein-statisztika
0 K-en 100%-os az előfordulása
300 K-en 25%-os az előfordulása
Izotópjai
A hidrogén leggyakoribb izotópja: 1H. Ennek a stabil izotópnak az atommagja egyetlen protonból áll; innen jön a prócium, a 1H ritkán használt neve.
A másik stabil izotóp a deutérium, 2H, aminek magjában egy neutron is található. A deutérium az összes hidrogén kb. 0,0184–0,0082%-a. A hidrogén és a deutérium egyaránt az ősrobbanásban keletkezett; a fúziós reakciók eredményeként mennyiségük azóta folyamatosan csökken.
A harmadik hidrogénizotóp a radioaktív trícium, 3H. A trícium atommagja két neutront tartalmaz a proton mellett. A földön a trícium a kozmikus sugárzás eredményeként keletkezik a légkörben, illetve a felszínen, ezért kiválóan alkalmas a beszivárgott és a felszín alatt messzire vándorolt vizek korának (a beszivárgás idejének) meghatározására.
A hidrogén az egyetlen olyan kémiai elem, aminek az izotópjait nemcsak külön elnevezték, de külön vegyjelet is adtak nekik – bár ez nem hivatalos. A deutériumot gyakran a D, a tríciumot a T betűvel jelölik (a 2H illetve 3H helyett).
Hélium
|
|
|
|
|
|
A hélium a periódusos rendszer második kémiai eleme, a legkisebb rendszámú nemesgáz. Vegyjele He, rendszáma 2. Színtelen és szagtalan, továbbá, lévén nemesgáz, kémiailag közömbös. Minden elem közül a hélium forráspontja a legalacsonyabb. A hidrogén után a második leggyakoribb elem a világegyetemben, de a Föld légkörében csak nyomokban fordul elő (kb. 0,0005%). Gazdaságosan a földgázból vonható ki. Felhasználják léggömbök és léghajók töltőanyagaként és hűtőanyagként, például szupravezető mágnesekben.
Története
Összefoglalás
A tudósvilág az ezernyolcszázas évek második felétől kezdte el helyesen értelmezni a hélium létezésére utaló jeleket. A színképelemzéssel foglalkozó, főként csillagász kutatók viszonylag korán (a hetvenes évek elején) arra a feltételezésre jutottak, hogy a Nap külső peremének, az ún. kromoszférának, valamint más égitesteknek a színképe egy addig ismeretlen és elemi jellegű anyag meglétére utalhat. Mintegy huszonöt év múlva a héliumot földi körülmények közt is előállították, ezzel igazolva azt, hogy egyáltalán létezik. A huszadik században rájöttek, hogy a hélium egészen közönséges elemnek számít a Világegyetemben (lévén a csillagokat működtető kémiai reakciók egyik végterméke), és különleges tulajdonságait (mint pl. egyes változatainak a szuperfolyékonysága) is felfedezték, továbbá fontos szerep jutott neki az atomfizikában és a kozmológiában.
A D3 színképvonal
A héliumra utaló jelet először Pierre Janssen francia csillagász észlelte egy 1868. augusztus 18-án kezdődött indiai napfogyatkozást megfigyelve Gunturban. A Francia Akadémia megbízásában álló Janssennek, aki a napfogyatkozás megfigyelésére Hátsó-Indiába induló 6 európai expedíció egyike volt, először volt alkalma, hogy megvizsgálja a Nap látható maradt részének emissziós színképét a J. Fraunhofer által bő fél évszázaddal korábban (1814-ben) feltalált és érdekes felfedezésekkel kecsegtető csillagászati spektroszkóppal.
Ahogyan várta, a kapott színkép fényes vonalakból állt. A legfényesebbek a Fraunhofer-féle C- és F-vonalak (a hidrogén vonalai) voltak, de ezeken kívül észrevett egy addig még le nem írt, meglehetősen fényes sárga vonalat is, nagyjából a nátrium D vonalainak helyén. Két nap múlva, egy felhős időszak után, sikerült megismételnie az eredményt a teljes Napkorongot vizsgálva. A következő hetekben (szept. 4-ig) Gunturban, majd a Himalája területén lázasan dolgozott egy új műszer, a spektrohelioszkóp megalkotásán, amelyre azért volt szükség, hogy a napfogyatkozás elmúltával is rekonstruálni tudja az eredményt, kiszűrve a már nem eltakart alsóbb szférák által kibocsátott zavaró hullámhosszakat, és megfigyelhesse a kromoszférát akár fényes nappal is. Erőfeszítéseit végül siker koronázta.
Két hónappal később és Janssentől függetlenül Normann Lockyer, a brit (ekkor még amatőr) csillagász is észlelte (napfogyatkozás nélkül) a Nap kromoszférájának színképében található rejtélyes sárga vonalat, amikor 1868. október 20-án kipróbálta új, nagyteljesítményû spektroszkópját.
Mindketten jelentésben számoltak be a Francia Akadémiának megfigyeléseikről; ezek különös véletlen folytán az Akadémia ugyanazon ülésére (október 26.) futottak be; és mellesleg olyan eredményesnek és jelentősnek találtattak, hogy pár évvel később emlékérmet is vertek tiszteletükre (1872), Janssen és Lockyer kettõs képével. A félreértések elkerülése végett azonban jegyezzük meg, hogy a francia kormány még nem a színképben foglalt új vonal észrevételéért, hanem a kromoszféra nappali megfigyelését lehetővé tevő eszköz (spektrohelioszkóp) kidolgozása, valamint a kromoszféra jelenségeinek (protuberanciák, stb.) leírása miatt jutalmazta őket; vagyis az éremnek a héliumhoz még nem sok köze volt.
Az új, 587,49 nm-es hullámhossznak megfelelő fényes sárga vonalat, amelyet laboratóriumban még soha senki nem figyelt meg azelőtt, és amely Fraunhofer 1817-es színképvonal-osztályzásában sem szerepelt, de amely a nátriumhoz kapcsolható „D” vonalakhoz (D1 és D2) állt a legközelebb, Janssen és Lockyer mellett többen is észlelték, és ama figyelemre méltó tényt is konstatálták, hogy a Nap „normális” (abszorbciós, azaz sötét vonalakból álló) színképében - nincs meg a neki megfelelő Fraunhofer-féle vonal. Ennek ellenére (valószínűleg a D-vonalakhoz való közelsége miatt) kezdetben egyszerűen a nátriumnak tulajdonították; kezdetben fel sem merült, hogy új elemre utalna. El is nevezték a Lockyer által „új D-vonalnak” leírt színképvonalat D3 vonalnak (ez az elnevezés, amely hamar elterjedt, valószínűleg P. A. Secchi olasz csillagásztól ered).
A vonalat, illetve hasonló vonalakat, amelyek néha együtt jártak a D3-mal, megtalálták más égitestek színképében is. Emissziós (világos) vonalként például Alfred Cornu megtalálta a Hattyú csillagkép egyik csillagában 1876-ban; 1888-ban Ralph Copeland pedig az Orion-köd színképében, 1894-ben James E. Keeler az Orion csillagkép Bétájának spektrumában; valamint ugyanő abszorbciós (sötét) vonalként az Orion egy másik csillagának színképében, mások abszorbciós vonalként egyes Wolf-Rayet csillagok, továbbá emissziós és abszorbciós vonalként egyaránt a Lant csillagkép Bétájának színképében.
A hélium mint hipotetikus elem
Lockyer már 1868. november 15-én megállapította, hogy a D3 vonal nem azonos hullámhosszú a nátrium D vonalával, tehát a neki megfelelő anyag a nátriumtól különbözik. Abban azonban maga sem volt biztos, hogy a vonal egy új elem hírnöke-e, több feljegyzésben és cikkében a kilencvenes évekig egyszerűen a hidrogén különleges formájának valószínűsítette, vagy más, hasonló magyarázatot keresett. Mindenesetre nem akart megelégedni azzal, hogy pusztán figyelje a tudományos sajtót, és közben elméleti spekulációkba merüljön, és szerencséjére, nem is kellett megelégednie ezzel. Edward Frankland, a nagy tudományos tekintéllyel rendelkező vegyész, hajlandó volt segíteni neki, többek között Lockyer rendelkezésére bocsátotta vegyi laboratóriumát és asszisztenseit, hogy segítse spektroszkópiai kutatásait, és azzal foglalkoztak, hogy különféle gázmintákat tettek ki a legkülönfélébb nyomás- és hőmérsékletviszonyoknak, majd spektrogrammot készítettek.
Lockyer és Frankland számos vitát folytattak (például levélben) a D3 vonal mögött meghúzódó anyag mibenlétéről. Valószínűleg az 1870-es évek elején merülhetett fel Lockyerben az a hipotézis, hogy ez az anyag egy egészen új kémiai elem (lehet, hogy már előbb is, de írott nyoma ennek nem maradt). Levelezésükből azonban az látszik, hogy Frankland nagyon kételkedő volt e feltevéssel szemben. Csak akkor volt hajlandó egyáltalán fontolóra venni e lehetőséget, amikor világossá vált számára (az 1870-es évek első éveiben), hogy a D3-nak semmiképp sem lehet a hidrogén semmilyen ismert formája az okozója.
Ekkoriban számos elemet fedeztek fel spektroszkóppal, melyekről nemsokára (vagy éppen sokára) kiderült, hogy valójában egyáltalán nem új elemek (korónium, jargónium, nigrium). Frankland továbbá egyáltalán nem volt egyedi példa: kémikusok nehezen fogadták el, hogy egy új anyagot annak előállítása nélkül, pusztán közvetett bizonyítékok alapján, létezőnek lehessen mondani. Mindezek miatt Lockyer óvakodott nyilvánosan írni vagy akár említést tenni az új elemről, melyet „héliumnak” nevezett el, a a görög Helios, azaz „Nap” szóból képezve. Ekkoriban írt munkáiban - Helge Kragh már idézett vizsgálatai szerint - egyáltalán nem fordul elő sem ez a szó, sem az a felvetés, hogy ismeretlen kémiai elem lenne.
Azonban informális csatornákon valószínűleg említést tett a dologról., ugyanis Lord Kelvin a Brit Királyi Társaság egyik 1871-es ülésén beszélt Lockyer és Frankland hélium-hipotéziséről. Ez egyben a „hélium” szó első ismert és bizonyítható nyilvános említése. A vegyészek (pl. William Benjamin Carpenter) azonban nagyon kedvezőtlenül fogadták a bejelentést: amíg nem láttak kézzel- vagy lombikkalfogható mennyiséget az új anyagból, addig nem akartak foglalkozni a dologgal.
Talán maga Lockyer sem hitt szilárdan a hélium-hipotézisben, az, hogy a hélium egy ismeretlen kémiai elem, csak egy volt a számtalan lehetőség közül (például amellett, hogy a hélium valamiféle hidrogén-módosulat) . Frankland is csak Lord Kelvin hatására volt hajlandó támogatni a csillagászt e véleményében.
Hélium a Földön
1882-ben az olasz meteorológus, Luigi Palmieri, a Vezúvon működő megfigyelőállomás vezetője, bejelentette, hogy - szintén spektrálelemzéssel - kimutatta a héliumot a vulkán lávájából. Ez valószínűsítette, hogy az elem (ha létezik egyáltalán) a Földön is előfordulhat; azonban Palmieri bejelentését meglehetős kételyekkel fogadták (állítólag semmilyen bizonyítékkal nem támasztotta alá az állítását; és másoknak sem sikerült megerősíteniük az eredményt; mindenesetre nem foglalkozott tovább a témával). Egy félreértés folytán ezt a felfedezést az olasz tudós halála után később William Ramsay-nak is tulajdonították, noha maga Ramsay elismerte Palmieri érdemeit. Nem teljesen lehetetlen, hogy Palmieri valóban megtalálta a héliumot (vulkáni gázokban néha, alkalomszerűen, igen kis mennyiségben előfordulhat, de egészen máig, nem is bizonyos.
A kilencvenes években W. F. Hillebrandnak sikerült először héliumot előállítania (1890), uránszurokércekből, vákuumban történő kénsavas melegítéssel. Hillebrand tapasztalta, hogy az ércből gáz fejlődik, amely „színtelen, szagtalan, éghetetlen, nem reagál levegővel keverve, semleges a lakmuszpapírokra, maró lúgokban nem nyelődik el, és vízben oldhatatlan (vagy legalábbis, túl kicsi az abszorbció mennyisége ahhoz, hogy észlelni lehessen) ... viszont hosszas szikráztatás hatására tiszta oxigénnel keverve nitrogénes savak keletkeznek belőle; sőt arra is rájött, hogy a gáz mennyiségét az uránszurokérc anyagi minősége egyértelműen meghatározza (lehetővé téve ezáltal az uránszurokércek osztályozását és felismerését), azonban a gázt tévesen tiszta nitrogénnek minősítette.
Ramsay a laborjában
Ramsay munkatársa a hélium kutatásában, J. N. Collie
Az első előállítás dicsősége így William Ramsay brit vegyészt illeti, aki 189-ben szintén nyers uránszurokérc egy fajtájából, egy Norvégiából származó cleveit-mintából állította elő a gázt (noha valójában az argont kereste), ásványi savas vákuumos melegítéssel. A keletkezett gázelegyből a nitrogént oly módon távolította el, hogy oxigént adott hozzá, majd elektromos szikrákat üttetett rajta keresztül, mígnem térfogata már nem változott. Ezután tömény kálium-hidroxid-oldatba vezette, amely a szikráztatáskor keletkezett nitrogén-oxidot és más nitrogénvegyületeket felfogta. Az így keletkezett és tisztított gázt Lockyer és William Crookes azonosította héliumként, miután spektroszkóppal megvizsgálták. Hillebrand az új elem felfedezéséről értesülve, levélben gratulált Ramsay-nek a sikeres kísérletért. Tőlük függetlenül Per Teodor Cleve és N. A. Langlet svéd kémikusoknak is sikerült nyers uránércből kivonnia héliumot Uppsalában, sőt sikerült akkora mennyiséget előállítaniuk a gázból, hogy az atomtömegét is meghatározhatták.
Ez a dátum egy csapásra megváltoztatta a hélium elfogadottságát: félig-meddig elméleti és hitbéli konstrukcióból, illetve a csillagok közé zárt távoli és elérhetetlen vágyálomból megkérdőjelezhetetlen valósággá változott.
Vizsgálatok alatt a hélium
A további vizsgálatok viszonylag rövid idő alatt kiderítették, hogy a hélium homogén vegyület, nem pedig keverék. Röviddel a hélium felfedezése után Carl Runge és Friedrich Paschen, akik spektroszkópos vizsgálataikkal (is) nagy tekintélyt szereztek maguknak a fizikusok és kémikusok között, nagyon alaposan megvizsgálták és lefényképezték a hélium színképét, és a „láthatatlan” (ultraibolya és infravörös) tartományban két olyan vonalsorozatra találtak, melyek alapján úgy tűnt, a héliumnak nevezett elem valójában két gáz keveréke (hasonló feltételezések születtek az argonról is). Nyomukban járva Ramsay és asszisztense, J. N. Collie különféle vizsgálatokat végeztek, melyek először szintén az inhomogenitásra utaltak: porózus csövön átvezetve, sikerült a héliumot diffúzióval két különböző levegőre vonatkoztatott sűrűségű (1.874 és 2.133) és törésmutatójú gázkomponensre bontani, melyek alapján a hélium keveréknek tűnt. Az eredményt azonban ők maguk is kételyekkel fogadták, mivel a kétféle gáz színképe tökéletesen megegyezett. Morris Travers (aki szintén Ramsay asszisztenseként dolgozott ebben az időben) kísérletei is az egyneműséget igazolták: a Plücker-féle csövekben az elektródokról a cső falára szublimáló platina elnyelte a gázt, az elnyelt és visszamaradott gáz között azonban semmilyen módszerrel nem talált különbséget, ami, ha a hélium több gáz keveréke volna, nehezen lenne magyarázható.
Már ekkoriban erősen valószínűsíthető volt, hogy a hélium egyatomos gázmolekulákból áll (Ramsay és Collie, továbbá A. Natterer). August Natterer szikráztatási kísérleteket végzett gázokkal, tapasztalatai szerint állandó nyomás és áramfeszültség mellett a maximális szikrahossz elsősorban a gázmolekulák atomjainak számától függ, egyatomos gázokban a legnagyobb, és az atomok számának növekedtével csökken. Néhány gáz mért maximális szikrahossza: oxigén 23 mm, levegő 33 mm, hidrogén 39 mm, argon 45.5 mm, hélium 250-300 mm. Az egyatomosság mellett más tapasztalatok, pl. fajhő-mérések és a törésmutatókra vonatkozó megfontolások is szóltak. Ennek ellenére voltak ezen elméleteknek ellenzői is, pl. Bohuslav Brauner cseh kémikus egy három hidrogénatomból álló Y alakú molekulát képzelt el, mint a hélium alkotóelemét. Mindezeket a tudósok a Royal Society ülésein megvitatták.
Hamarosan felfedezték, hogy a hélium kémiailag meglehetősen passzív elem. Még Ramsay és N. Collie megállapították, hogy a héliummal még in statu nascendi sem reagálnak a következő elemek: Na, Si, Be, Zn, Cd, B, Y, Tl, Ti, Th, Sn, Pb, P, As, Sb, Bi, Se, S, U, Co, Cl, Pt.
A hélium közönségessé válik
1905-ben amerikai vegyészek (Hamilton Cady és David McFarland) felfedezték, hogy a hélium földgázból is kivonható. 1907-ben Ernest Rutherford és Thomas Royds bebizonyította, hogy a radioaktív bomlás alfa-részecskéje megegyezik a hélium atommagjával. A héliumot először egy holland tudós, Heike Kamerlingh Onnes cseppfolyósította 1908-ban, amikor sikerült 1 K alá hűtenie a gázt. 1926-ban tanítványa, Willem Hendrik Keesom állított elő szilárd halmazállapotú héliumot. 1938-ban Pjotr Leonyidovics Kapica orosz fizikus megfigyelte, hogy a hélium-4 viszkozitása (belső súrlódása) az abszolút nulla fok közelében szinte nullára csökken – ez a jelenség a szuperfolyékonyság. 1972-ben Douglas D. Osheroff, David M. Lee és Robert C. Richardson amerikai fizikusoknak a hélium-3 szuperfolyékonyságot is sikerült kimutatniuk.
Állapotai
Normálállapotban a hélium egyatomos gáz. Kizárólag nagy nyomáson szilárdul meg – eközben a sűrűsége jelentősen megnő. 4,21 kelvines forráspontja alatt, de a lambda pontnak nevezett 2,1768 kelvin fölött a hélium-4 izotóp normális folyékony állapotban van, amit hélium I-nek neveznek. A lambda pont alatt furcsán kezd viselkedni, és egy hélium II-nek nevezett állapotba kerül. A hélium-3 izotóp viselkedéséről kevesebbet tudunk.
Hélium II
A hélium II viselkedését leginkább két, különböző tulajdonságú folyadék elegyeként írhatjuk le. Szuperfolyékony: nincs belső súrlódása, gyorsan folyik keresztül akár a legkisebb átmérőjű csöveken, és úgy mászik fel a tárolóedény falán – ez a szökőkút-effektus – mintha a gravitáció nem is hatna rá. Hővezető képessége nagyobb bármilyen ismert anyagénál. Ha hőt közlünk vele, a hő igen gyorsan, hőmérsékleti hullámokban (más terminológiával: második hangként) terjed benne.
Reakciók
A hélium normális körülmények között nem lép reakcióba más elemekkel. Elektromos kisülésekben, illetve ha elektronokkal bombázzuk, egyes elemekkel: a volfrámmal, a jóddal, a fluorral, a kénnel, illetve a foszforral alkothat excimereket.
Izotópjai, előfordulása
A hélium a hidrogén után a második leggyakoribb elem, az ismert világegyetem tömegének kb. egynegyede. Bár 6 izotópját ismerjük, ezek közül csak a 3He és a 4He stabil, a többi gyorsan elbomlik más anyagokra. Leggyakoribb izotópja, a hélium-4 elsöprő többsége az ősrobbanásból keletkezett. A csillagokban a hidrogénfúzió eredményeként és a szén-nitrogén ciklusban, földi körülmények között a nehezebb elemek alfa-bomlásával jön létre. Ez egy különlegesen stabil atommag, mivel a nukleonok teljes héjakba rendeződnek benne. Hélium-3 izotóp a Földön csak nyomokban található, a trícium béta-bomlása során keletkezik.
Földünk légkörében a hélium részaránya csak 1:200 000 – leginkább azért, mert rendkívül könnyű, és ezért a Föld gravitációja nem tudja huzamosan megtartani. Mivel a földi hélium radioaktív bomlástermék, ezért elsődlegesen az urán és a tórium érceiben található meg. Csekély mennyiségben ásványvizekben, vulkáni gázokban, meteorvasban is megtalálható, mint pl. Fekete-erdő Wildbad-forrása, a Pireneusok kénforrásai, a lotharingiai Maizières-forrás, az angliai Bath forrásai.
Jóval nagyobb jelentőségűek azok a lelőhelyek, ahol a földgázban oldva fordul elő, egyes földgázokban 1,6-1,8%-ig is felszaporodhat, ezért az iparban is főképp földgázból állítják elő. A világ fő héliumforrásai a texasi, oklahomai és kansasi földgázlelőhelyek.
Érdekesség: 1968-ban a texasi Amarillo-ban, amit a világ Hélium-fővárosának is hívnak, felállítottak egy héliummal töltött 18 méter magas üreges acél emlékművet, melynek négy végébe egy-egy időkapszulát helyeztek. A Helium Monument időkapszulák tervezett kinyitási ideje 1993, 2018, 2068 és 2968.
Előállítása
- Mivel a legnehezebb elemek radioaktív bomlásakor keletkezik, urán és tórium tartalmú kőzetek hevítésével felszabadítható a bennük elnyelődött hélium.
- Földgázból vonható ki úgy, hogy cseppfolyósításakor a hélium kivételével minden gáz lecsapódik.
- A héliumot részecskegyorsítókban úgy is előállíthatjuk, ha lítiumot vagy bórt bombázunk gyors protonokkal.
Felhasználása
Hélium kisülési csőben
A földgázból kivont, nagy nyomás alatt tárolt hélium a kereskedelemben kapható.
Számos célra használják:
- Mivel könnyebb a levegőnél, léghajók és léggömbök töltőanyaga lehet. Előnyösebb a hidrogénnél, mert nem gyúlékony, és a hidrogén emelőerejének 92,64%-át nyújtja.
- A héliumot belélegzett személy hangja időlegesen magasabb lesz, mivel a hang a héliumban a levegőnél háromszor gyorsabban terjed, és ilyen arányban magasabbak lesznek a gégében a rezonáns frekvenciák. Bár ez jó szórakozás, a koncentrált hélium használata az oxigénhiány miatt halált is okozhat.
- A mélytengeri búvárok trimixet, azaz hélium, nitrogén és oxigén keverékét használják légzőberendezéseikben, hogy csökkentsék a nagy nyomáson, normál levegő használatával fellépő nitrogén-narkózis (a nitrogén nagy parciális nyomása okozta eufórikus állapot), a keszonbetegség és az oxigén-toxicitás esélyét.
- Különlegesen alacsony olvadás- és forrpontja miatt hűtőanyagként használják MRI-berendezéseknél, nukleáris reaktoroknál, szupravezető mágneseknél és a kriogenikában.
- Kémiai közömbössége miatt védőgázként használják szilícium- és germániumkristályok növesztésekor, a titán- és cirkónium-kitermelésben, ívhegesztéskor és a gázkromatográfiában.
- Folyékony üzemanyagú rakétákban a túlnyomás elérésére használják.
- Héliumot használnak szuperszonikus sebességű szélcsatornákban.
- A hélium-neon lézer erősítő közegeként hélium és neon elegyét használják.
- A nagyfeszültségű kisülési csövekben (fénycső) töltőgázként alkalmazzák.
- Héliumot alkalmaznak szivárgások tesztelésre akár olyan termékek összeszerelésénél, amelyek szivárgása nem engedhető meg (például üzemanyagszivattyúk), akár csővezetékek szivárgásának ellenőrzésére is. A hélium azért különösen alkalmas a szivárgás ellenőrzésére, mert egyrészt kis viszkozitása miatt könnyen átjut minden lyukon, továbbá, másrészt kvadrupol tömegspektrométerrel könnyen és igen érzékenyen mérhető.
- Használják élelmiszerek konzerválására is.
- Érdekessége,hogy cseppfolyós állapotban erősen felkeverve akár 1 hónapig is képes mozgásban lenni a rendkívül kicsi viszkozitása miatt.
Lítium
|
|
|
|||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
Általános |
||||||||||||||||||||||||||
|
Név, vegyjel, rendszám |
lítium, Li, 3 |
|||||||||||||||||||||||||
|
Elemi sorozat |
Alkálifémek |
|||||||||||||||||||||||||
|
Csoport, periódus, mező |
1, 2, s |
|||||||||||||||||||||||||
|
Megjelenés |
ezüstfehér, szürke
|
|||||||||||||||||||||||||
|
Atomtömeg |
6,941 g/mol |
|||||||||||||||||||||||||
|
Elektronszerkezet |
[He] 2s1 |
|||||||||||||||||||||||||
|
Elektronok héjanként |
2, 1 |
|||||||||||||||||||||||||
|
Fizikai tulajdonságok |
||||||||||||||||||||||||||
|
Halmazállapot |
Szilárd |
|||||||||||||||||||||||||
|
Sűrűség (szobahőm.) |
0,535 g/cm³ |
|||||||||||||||||||||||||
|
Sűrűség (folyadék) az o.p.-on |
0,512 g/cm³ |
|||||||||||||||||||||||||
|
Olvadáspont |
453,69 K |
|||||||||||||||||||||||||
|
Forráspont |
1615 K |
|||||||||||||||||||||||||
|
Olvadáshő |
3,00 kJ/mol |
|||||||||||||||||||||||||
|
Párolgáshő |
147,1 kJ/mol |
|||||||||||||||||||||||||
|
Moláris hőkapacitás |
(25 °C) 24,860 J/(mol·K) |
|||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
Atomi tulajdonságok |
||||||||||||||||||||||||||
|
Kristályszerkezet |
köbös tércentrált |
|||||||||||||||||||||||||
|
Oxidációs állapotok |
1 |
|||||||||||||||||||||||||
|
Elektronegativitás |
0,98 (Pauling-skála) |
|||||||||||||||||||||||||
|
Ionizációs energia |
1.: 520,2 kJ/mol |
|||||||||||||||||||||||||
|
2.: 7298,1 kJ/mol |
||||||||||||||||||||||||||
|
3.: 11815,0 kJ/mol |
||||||||||||||||||||||||||
|
Atomsugár |
145 pm |
|||||||||||||||||||||||||
|
Atomsugár (számított) |
167 pm |
|||||||||||||||||||||||||
|
Kovalens sugár |
134 pm |
|||||||||||||||||||||||||
|
Van der Waals-sugár |
182 pm |
|||||||||||||||||||||||||
|
Egyebek |
||||||||||||||||||||||||||
|
Mágnesség |
nem mágneses |
|||||||||||||||||||||||||
|
Fajlagos ellenállás |
(20 °C) 92,8 nΩ·m |
|||||||||||||||||||||||||
|
Hővezetési tényező |
(300 K) 84,8 W/(m·K) |
|||||||||||||||||||||||||
|
Hőtágulási tényező |
(25 °C) 46 µm/(m·K) |
|||||||||||||||||||||||||
|
Hangsebesség (vékony rúd) |
(20 °C) 6000 m/s |
|||||||||||||||||||||||||
|
Young-modulus |
4,9 GPa |
|||||||||||||||||||||||||
|
Nyírási modulus |
4,2 GPa |
|||||||||||||||||||||||||
|
Bulk modulusz |
11 GPa |
|||||||||||||||||||||||||
|
Mohs-keménység |
0,6 |
|||||||||||||||||||||||||
|
Brinell-keménység |
- HB |
|||||||||||||||||||||||||
|
CAS-szám |
7439-93-2 |
|||||||||||||||||||||||||
|
Fontosabb izotópok |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
A lítium (nyelvújításkori magyar nevén: lavany) a periódusos rendszer egy kémiai eleme. Vegyjele Li, rendszáma 3. Az I. főcsoportba, az alkálifémek közé tartozik. Elemi állapotban ezüstfehér színű, lágy, jól nyújtható könnyűfém, nedves levegő vagy víz hatására felületén sárga oxid- és nitridbevonat képződik. A legkönnyebb szilárd halmazállapotú elem. Főként hővezető ötvözetekben, akkumulátorokban, és hangulatbefolyásoló gyógyszerekben alkalmazzák.
|
|
Története
A lítiumot (görögül lithos, jelentése „kő”) 1817-ben fedezte fel Johann Arfvedson. Arfvedsonnak a svéd Utö szigeten talált petalit ércben (LiAl(Si2O5)2) lévő szpodumen és lepidolit ásványban sikerült megtalálnia az új elemet. 1818-ban Christian Gmelin figyelte meg először, hogy a lítium sói a lángot élénkvörösre színezik. Egyiküknek sem sikerült azonban a lítiumot sóiból elkülönítenie.
Az izoláció először W.T. Brande-nak és Sir Humphrey Davy-nek sikerült, akik elektrolízist alkalmaztak lítium-oxidon (Li2O). Kereskedelmi mennyiségben először 1923-ban állította elő a német Metallgesellschaft AG, megolvasztott lítium-klorid (LiCl) és kálium-klorid (KCl) elektrolízisével.
A „lítium” név a lithion=kőszerű szóból származik, mert ásványban mutatták ki először, míg a többi alkálifémet először növényi szövetben.
Jellemzői
A lítium ezüstfehér, puha fém; a legkönnyebb a fémek között, sűrűsége mindössze fele a vízének. Más alkálifémekhez hasonlóan egy vegyértékű elem. A vízzel azonnal kölcsönhatásba lép, noha még mindig nehezebben lép reakcióba, mint a kémiai szempontból hasonló nátrium. Aktivitása miatt szabad formában nem is található meg a természetben. Az alkálifémek között a legkevésbé aktív. A tiszta nitrogén már szobahőmérsékleten egyesül vele. Ha szénnel hevítjük Li2C2 keletkezik.
Felhasználása
Fajhője a szilárd elemek közül a legnagyobb, ezért a lítiumot hőcserélőkben használják. Magas elektrokémiai potenciálja miatt akkumulátorokban is alkalmazzák anódként. Egyéb felhasználási területei:
- sói közül a lítium-karbonát (Li2CO3) és a lítium-citrát (Li3C6H5O7) mániás-depressziós zavarok gyógyszere
- a lítium-klorid és a lítium-bromid (LiBr) erősen nedvszívó hatásúak, például alumínium és magnézium hegesztésénél alkalmazzák
- a lítium-sztearát általános célú, magas hőmérsékleten is használható kenőanyag
- felhasználják szerves vegyületek gyártása során, és az atomenergia-iparban is
- üvegekben, kerámiákban alkalmazzák, például a Palomar-hegyi 5 méteres teleszkópban is
- lítium-hidroxiddal (LiOH) vonják ki a szén-dioxidot az űrhajók és tengeralattjárók levegőjéből
- alumíniummal, kadmiummal, rézzel, mangánnal képzett ötvözeteit felhasználják a repülőgépgyártásban
Izotópjai
A természetben a lítiumnak két stabil izotópja fordul elő, a 6Li és a 7Li, ezek közül a 7Li a gyakoribb (92,5%-os előfordulási arány). Hat radioaktív izotópja van, közülük legstabilabb a 8Li, 838 ms-os felezési idővel és a 9Li, 178,3 ms-os felezési idővel. A többi radioaktív izotóp felezési ideje 8,5 ms-nál kisebb, illetve nem ismert.
A lítium izotópjainak relatív atomtömege 4,027 u 4Li és 11,0438 u 11Li közé esik. A leggyakoribb stabil izotóp, 7Li előtti izotópok elsősorban proton-emisszióval bomlanak (egy esetben alfa-bomlással), a 7Li utániak pedig béta-bomlással (némelyik neutron-emisszióval). A 7Li előtti bomlás termékei elsősorban hélium-izotópok, a 7Li utániak esetében pedig berillium-izotópok.
A 7Li egyike a legősibb kémiai elemeknek (jó része még az ősrobbanásban keletkezett). A lítium izotópjai számos természeti folyamatban részt vesznek, köztük az ércképződésben (üledékképződés), anyagcserében, ioncserében (a lítium a magnéziumot és vasat lecseréli az oktahedrális helyekről agyagásványokban, a 6Li könnyebben mint a 7Li), a hiperfiltrációban (fordított ozmózis, ivóvíz előállításában).
Előfordulása
A lítium széles körben elterjedt elem, de a természetben elemi formájában nem fordul elő. Nagy reakciókészsége miatt mindig más elemekhez kötődve vagy vegyületekben fordul elő. Megtalálható a tengervízben, és csaknem minden vulkanikus kőzetben.
A II. világháború óta a lítium kitermelése jelentősen megnőtt. Vulkáni kőzetek többi alkotóelemétől különítik el, vagy ásványvizekből vonják ki. Lepidolit (lítiumcsillám), szpodumen, petalit és ambligonit (LiAl[PO4F]) a legfontosabb kőzetek amik tartalmazzák.
Az USA-ban a lítiumot kiszáradt tavak medréből vonják ki, Kaliforniában, Nevadában és még néhány helyen. Az ezüstös fényű fémet elektrolízissel vonják ki olvadt lítium és kálium-klorid elegyéből.
Óvintézkedések
Ahogy más alkálifémek, úgy a lítium is elemi formában erősen gyúlékony és kismértékben robbanásveszélyes, ha levegőnek, de főleg ha víznek van kitéve. Korrozív hatású, és különleges kezelést igényel a bőrrel való érintkezés elkerülése végett. Tárolása kémiailag kevéssé reakcióképes folyékony szénhidrogénben, például benzinben történik. A lítium a természetes élettani folyamatokban nem játszik szerepet, és enyhén mérgezőnek tartják. Ezért ha gyógyszerként használják, a vérben lévő koncentrációját rendszeresen ellenőrizni kell.
Berillium
|
|||||||||||||||||||||||||||||||
|
Általános |
|||||||||||||||||||||||||||||||
|
Név, vegyjel, rendszám |
berillium, Be, 4 |
||||||||||||||||||||||||||||||
|
Elemi sorozat |
Alkáliföldfémek |
||||||||||||||||||||||||||||||
|
Csoport, periódus, mező |
2, 2, s |
||||||||||||||||||||||||||||||
|
Megjelenés |
Szürkésefehér
|
||||||||||||||||||||||||||||||
|
Atomtömeg |
9,01218 g/mol |
||||||||||||||||||||||||||||||
|
Elektronszerkezet |
[He] 2s2 |
||||||||||||||||||||||||||||||
|
Elektronok héjanként |
2, 2 |
||||||||||||||||||||||||||||||
|
Fizikai tulajdonságok |
|||||||||||||||||||||||||||||||
|
Halmazállapot |
Szilárd |
||||||||||||||||||||||||||||||
|
Sűrűség (standard) |
1,848 g/cm³ |
||||||||||||||||||||||||||||||
|
Olvadáspont |
1005 K |
||||||||||||||||||||||||||||||
|
Forráspont |
2697 K |
||||||||||||||||||||||||||||||
|
Olvadáshő |
12,20 kJ/mol |
||||||||||||||||||||||||||||||
|
Párolgáshő |
292,40 kJ/mol |
||||||||||||||||||||||||||||||
|
Atomi tulajdonságok |
|||||||||||||||||||||||||||||||
|
Kristályszerkezet |
Hexagonális |
||||||||||||||||||||||||||||||
|
Oxidációs állapotok |
2 |
||||||||||||||||||||||||||||||
|
Elektronegativitás |
1,57 (Pauling-skála) |
||||||||||||||||||||||||||||||
|
Ionizációs energia |
1.: 899,5 kJ/mol |
||||||||||||||||||||||||||||||
|
2.: 1757,1 kJ/mol |
|||||||||||||||||||||||||||||||
|
3.: 14848,7 kJ/mol |
|||||||||||||||||||||||||||||||
|
Atomsugár |
112 pm |
||||||||||||||||||||||||||||||
|
Kovalens sugár |
90 pm |
||||||||||||||||||||||||||||||
|
Egyebek |
|||||||||||||||||||||||||||||||
|
Mágnesség |
Diamágneses |
||||||||||||||||||||||||||||||
|
Hangsebesség (vékony rúd) |
(20 °C) 13000 m/s |
||||||||||||||||||||||||||||||
|
Mohs-keménység |
5,5 |
||||||||||||||||||||||||||||||
|
Fontosabb izotópok |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
A berillium a periódusos rendszer egy kémiai eleme. Vegyjele Be, rendszáma 4. Az II. főcsoportba, az alkáliföldfémek közé tartozik. Szürkés színű, kis fajsúlyú, igen kemény, rideg fém, elsősorban ötvözetek keményítő anyagaként hasznosítják. Kémiai tulajdonságai leginkább az alumíniuméhoz hasonlíthatóak. Mérgező, két vegyértékű elem.
Története
Nevét a berill (görög beryllos – zöld drágakő) nevű ásványról kapta, amelyben 1798-ban megtalálták. Egy időben glucíniumnak is hívták (a görög glykys, édes szóból), sóinak édes íze miatt. Louis Vauquelin fedezte fel 1798-ban berill ásványban és smaragdban. Először Friedrich Wöhlernek és A. B. Bussynak sikerült kivonnia 1828-ban berillium-kloridból kálium segítségével.
Jellemzői
Olvadáspontja (1277 °C) és forráspontja (2970 °C) a legmagasabb az alkáliföldfémek között. Jó hővezető. Fémfényét megtartja a levegőn, felületén igen vékony védő oxidréteg képződik. Sósavban oldódik, oxidáló savak hidegen nem támadják meg – ellenáll akár a koncentrált salétromsavnak is. Alkálilúgok melegen oldják.
Vízben oldható vegyületei mérgezőek. A berillium az egyetlen a csoportjában, amely nem képez ionos kötést és kationt. A Be2+ ionnak annyira erős a polarizáló hatása, hogy még a legnehezebben polarizálható anionok elektronfelhőit is deformálja, kovalens kötést létesítve velük.
Felhasználása
- a berillium-réz ötvözetet tulajdonságai miatt (jó hő- és elektromos vezetőképesség, nagy szilárdság és keménység, nem mágneses, korrózióálló) ponthegesztésnél elektródaként, rugókban, elektromos érintkezőkben alkalmazzák
- szilárdsága, kis fajsúlya miatt, és mert térfogata széles hőmérsékleti tartományban közel állandó, a berillium-réz ötvözetet felhasználják repülőgépekben, rakétákban, űrjárművekben és távközlési műholdakban
- vékony berillium-fóliát használnak a röntgendiagnosztikában a látható fénytartomány kiszűrésére
- röntgenlitográfiában használják integrált áramkörök sokszorosításához
- mivel a láncreakciók szempontjából igen fontos lassú neutronokat könnyen átengedi (neutronszűrő), nukleáris reaktorokban reflektorként és moderátor anyagként hasznosítják
- rendkívül rugalmas ötvözeteket képez, ezért felhasználják giroszkópok, órarugók, más gépalkatrészek alkotóelemeként
- a berillium-oxidot ott alkalmazzák, ahol fontos a jó hővezetés, keménység, magas olvadáspont, és elektromos szigetelés
- a berillium vegyületeit valamikor fénycsövekben használták, de a munkásokban fellépő berilliózis miatt áttértek más anyagok használatára.
Előfordulása
Több mint 30 ásványban fordul elő, ezek közül a legfontosabbak a bertrandit, a berill, Be3Al2(Si6O18) és a krizoberill, BeOAl2O3. Ez utóbbi Brazíliában, az Urálban és Norvégiában található meg.
A drágakövek közül berilliumot tartalmaz az akvamarin és a smaragd. Az ipari mennyiségű berillium legfontosabb forrása a berill és bertrandit érc. Előállítása berillium-fluorid magnéziummal történő redukálásával történik. A fém-berillium 1957 óta hozzáférhető a kereskedelemben.
Előállítása
BeF2+Mg -> MgF2+Be
Izotópjai
A berilliumnak egyetlen stabil izotópja van, a Be-9. A kozmikus eredetű Be-10 a Föld légkörében keletkezik, az oxigén- és nitrogénatomok kozmikus sugárzás általi hasításával. Mivel a berillium 5,5-ös pH szint alatt általában oldott formában van jelen, és az esővíz pH-ja 5-nél kisebb, kimosódik a légkörből és eljut a földfelszínre.
Ahogy a csapadék egyre lúgosabbá válik, a berillium kicsapódik az oldatból. A kozmikus eredetű Be-10 így felgyülemlik a talajszinten, ahol a viszonylag hosszú (1,5 millió év) felezési idő miatt sokáig tartózkodik, mielőtt B-10 (bór)-rá bomlik. A Be-10 izotópot és bomlástermékeit a talaj eróziójának, a málladékból történő talajképződésnek, a laterit talaj kialakulásának vizsgálatában használják, valamint a naptevékenység változásainak tanulmányozásában.
A Be-7 és Be-8 instabilitásának igen fontos kozmológiai következménye, hogy berilliumnál nehezebb elemek nem keletkeztek az ősrobbanáskor magfúzióval. Ráadásul, a berillium-8 magenergia-szintjei lehetővé teszik a szén keletkezését a csillagokban, ami az élet alapeleme.
Fejlesztés alatt!